Skandium, med grundämnessymbolen Sc och atomnummer 21, är lättlöslig i vatten, kan interagera med varmt vatten och mörknar lätt i luften. Dess huvudvalens är +3. Den blandas ofta med gadolinium, erbium och andra grundämnen, med lågt utbyte och en halt på cirka 0,0005 % i jordskorpan. Scandium används ofta för att tillverka specialglas och lätta högtemperaturlegeringar.
För närvarande är de bevisade scandiumreserverna i världen endast 2 miljoner ton, varav 90–95 % finns i bauxit-, fosforit- och järn-titanmalmer, och en liten del i uran-, torium-, volfram- och sällsynta jordartsmetaller, huvudsakligen fördelade i Ryssland, Kina, Tadzjikistan, Madagaskar, Norge och andra länder. Kina är mycket rikt på scandiumresurser, med enorma mineralreserver relaterade till scandium. Enligt ofullständig statistik är scandiumreserverna i Kina cirka 600 000 ton, vilka finns i bauxit- och fosforitfyndigheter, porfyr- och kvartsvolframfyndigheter i södra Kina, sällsynta jordartsmetallfyndigheter i södra Kina, Bayan Obo-järnmalmsfyndigheter i Inre Mongoliet och Panzhihua-vanadin-titanmagnetitfyndigheter i Sichuan.
På grund av bristen på scandium är priset på scandium också mycket högt, och som mest var scandiumpriset uppblåst till 10 gånger guldpriset. Även om scandiumpriset har fallit är det fortfarande fyra gånger guldpriset!
Upptäck historia
År 1869 upptäckte Mendeleev ett gap i atommassan mellan kalcium (40) och titan (48) och förutspådde att det också fanns ett oupptäckt mellanliggande atommassaelement här. Han förutspådde att dess oxid är X₂OÅ. Skandium upptäcktes 1879 av Lars Frederik Nilson vid Uppsala universitet i Sverige. Han utvann det från den svarta sällsynta guldgruvan, en komplex malm som innehåller 8 typer av metalloxider. Han har utvunnetErbium(III)oxidfrån svart sällsynt guldmalm, och utvunnenYtterbium(III)oxidfrån denna oxid, och det finns en annan oxid av ett lättare element, vars spektrum visar att det är en okänd metall. Detta är den metall som Mendeleev förutspådde, vars oxid ärSc₂O₃Själva scandiummetallen framställdes frånSkandiumkloridgenom elektrolytisk smältning 1937.
Mendelejev
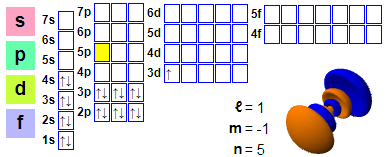
Elektronkonfiguration
Elektronkonfiguration: 1s² 2s² 2p6 3s² 3p6 4s² 3d1
Scandium är en mjuk, silvervit övergångsmetall med en smältpunkt på 1541 ℃ och en kokpunkt på 2831 ℃.
Under en avsevärd tid efter dess upptäckt demonstrerades inte användningen av scandium på grund av dess svårigheter att producera. Med den ökande förbättringen av separationsmetoder för sällsynta jordartsmetaller finns det nu ett moget processflöde för rening av scandiumföreningar. Eftersom scandium är mindre alkaliskt än yttrium och lantanid är hydroxiden den svagaste, så det blandade mineralet med sällsynta jordartsmetaller som innehåller scandium kommer att separeras från det sällsynta jordartsmetallet genom "stegvis utfällning"-metoden när scandium(III)hydroxid behandlas med ammoniak efter att ha överförts till lösning. Den andra metoden är att separera scandiumnitrat genom polär nedbrytning av nitrat. Eftersom scandiumnitrat är lättast att bryta ner kan scandium separeras. Dessutom är den omfattande återvinningen av medföljande scandium från uran, torium, volfram, tenn och andra mineralfyndigheter också en viktig källa till scandium.
Efter att en ren scandiumförening erhållits omvandlas den till ScCl₃Å och smälts tillsammans med KCl och LiCl. Den smälta zinken används som katod för elektrolys, vilket får scandium att fällas ut på zinkelektroden. Sedan avdunstas zinken för att erhålla metalliskt scandium. Detta är en lätt silvervit metall med mycket aktiva kemiska egenskaper, som kan reagera med varmt vatten för att generera vätgas. Så metallen scandium som du ser på bilden är förseglad i en flaska och skyddad med argongas, annars kommer scandium snabbt att bilda ett mörkgult eller grått oxidlager och förlora sin glänsande metalliska lyster.
Applikationer
Belysningsindustrin
Användningen av scandium är koncentrerad till mycket ljusa riktningar, och det är ingen överdrift att kalla det Ljusets Son. Scandiums första magiska vapen kallas scandiumnatriumlampa, som kan användas för att lysa upp tusentals hushåll. Detta är ett elektriskt metallhalogenlampa: glödlampan är fylld med natriumjodid och scandiumtrijodid, och scandium- och natriumfolie tillsätts samtidigt. Under högspänningsurladdning avger scandiumjoner respektive natriumjoner ljus med sina karakteristiska emissionsvåglängder. Spektrallinjerna för natrium är 589,0 och 589,6 nm, två kända gula ljus, medan spektrallinjerna för scandium är 361,3~424,7 nm, en serie av nära ultraviolett och blått ljus. Eftersom de kompletterar varandra är den övergripande ljusfärgen som produceras vitt ljus. Det är just för att scandiumnatriumlampor har egenskaper som hög ljuseffektivitet, bra ljusfärg, energibesparing, lång livslängd och stark dimbrytningsförmåga som de kan användas i stor utsträckning för TV-kameror, torg, idrottsarenor och vägbelysning, och är kända som tredje generationens ljuskällor. I Kina marknadsförs denna typ av lampa gradvis som en ny teknik, medan i vissa utvecklade länder användes denna typ av lampa i stor utsträckning redan i början av 1980-talet.
Scandiums andra magiska vapen är solceller, som kan samla in ljus som sprids på marken och omvandla det till elektricitet för att driva det mänskliga samhället. Scandium är den bästa barriärmetallen i metallisolatorer, halvledarkiselsolceller och solceller.
Dess tredje magiska vapen kallas γA-strålkälla. Detta magiska vapen kan lysa starkt på egen hand, men denna typ av ljus kan inte tas emot av blotta ögat, det är ett högenergiskt fotonflöde. Vi utvinner vanligtvis 45Sc från mineraler, vilket är den enda naturliga isotopen av scandium. Varje 45Sc-kärna innehåller 21 protoner och 24 neutroner. 46Sc, en artificiell radioaktiv isotop, kan användas som γ-strålningskällor eller spåratomer som också kan användas för strålbehandling av maligna tumörer. Det finns också tillämpningar som yttrium, gallium, scandium och granatlaser.Skandiumfluoridglasinfraröd optisk fiber och scandiumbelagt katodstrålerör på tv. Det verkar som att scandium föds med ljusstyrka.
Legeringsindustrin
Skandium i sin elementära form har använts flitigt för dopning av aluminiumlegeringar. Så länge några tusendels skandium tillsätts till aluminium bildas en ny Al3Sc-fas, som spelar en metamorfos roll i aluminiumlegeringar och gör att legeringens struktur och egenskaper förändras avsevärt. Att tillsätta 0,2%~0,4% Sc (vilket är i stort sett likt andelen salt som tillsätts i wokade grönsaker hemma, bara en liten mängd behövs) kan öka legeringens omkristallisationstemperatur med 150-200 ℃ och avsevärt förbättra högtemperaturhållfastheten, strukturstabiliteten, svetsprestanda och korrosionsbeständigheten. Det kan också undvika försprödningsfenomenet som lätt uppstår vid långvarigt arbete vid höga temperaturer. Aluminiumlegeringar med hög hållfasthet och hög seghet, nya höghållfasta korrosionsbeständiga svetsbara aluminiumlegeringar, nya högtemperaturaluminiumlegeringar, höghållfasta neutronbestrålningsbeständiga aluminiumlegeringar etc. har mycket attraktiva utvecklingsmöjligheter inom flyg- och rymdfart, flyg, fartyg, kärnreaktorer, lätta fordon och höghastighetståg.
Scandium är också ett utmärkt modifieringsmedel för järn, och en liten mängd scandium kan avsevärt förbättra gjutjärnets styrka och hårdhet. Dessutom kan scandium också användas som tillsats för högtemperaturlegeringar av volfram och krom. Naturligtvis, förutom att tillverka bröllopskläder för andra, har scandium en hög smältpunkt och dess densitet liknar aluminium, och används även i lättviktslegeringar med hög smältpunkt, såsom scandium-tianlegering och scandium-magnesiumlegering. Men på grund av sitt höga pris används det i allmänhet endast i avancerade tillverkningsindustrier som rymdfärjor och raketer.
Keramiskt material
Skandium, ett enda ämne, används vanligtvis i legeringar, och dess oxider spelar en viktig roll i keramiska material på ett liknande sätt. Det tetragonala zirkoniumkeramiska materialet, som kan användas som elektrodmaterial för fastoxidbränsleceller, har en unik egenskap där elektrolytens konduktivitet ökar med ökande temperatur och syrekoncentration i miljön. Emellertid kan kristallstrukturen hos detta keramiska material inte existera stabilt och har inget industriellt värde. Det är nödvändigt att dopa vissa ämnen som kan fixera denna struktur för att bibehålla dess ursprungliga egenskaper. Att tillsätta 6~10 % skandiumoxid är som en betongstruktur, så att zirkonium kan stabiliseras på ett fyrkantigt gitter.
Det finns också tekniska keramiska material såsom höghållfast och högtemperaturbeständig kiselnitrid som förtätningsmedel och stabilisatorer.
Som en förtätningsmedel,Skandiumoxidkan bilda en eldfast fas Sc2Si2O7 vid kanten av fina partiklar, vilket minskar högtemperaturdeformationen hos tekniska keramiker. Jämfört med andra oxider kan det bättre förbättra de mekaniska högtemperaturegenskaperna hos kiselnitrid.
Katalytisk kemi
Inom kemiteknik används scandium ofta som katalysator, medan Sc₂O₃ kan användas för dehydrering och deoxidering av etanol eller isopropanol, sönderdelning av ättiksyra och produktion av etylen från CO och H₂. Pt₃Al-katalysatorn som innehåller Sc₂O₃ är också en viktig katalysator för rening och raffinering av tungolja inom petrokemisk industri. I katalytiska krackningsreaktioner, såsom kumen, är aktiviteten hos Sc-Y-zeolitkatalysatorn 1000 gånger högre än hos aluminiumsilikatkatalysatorn. Jämfört med vissa traditionella katalysatorer kommer utvecklingsutsikterna för scandiumkatalysatorer att vara mycket ljusa.
Kärnkraftsindustrin
Genom att tillsätta en liten mängd Sc2O3 till UO2 i kärnbränsle i högtemperaturreaktorer kan man undvika gittertransformation, volymökning och sprickbildning orsakad av omvandling av UO2 till U3O8.
Bränslecell
På liknande sätt kommer tillsats av 2,5 % till 25 % scandium till nickelalkalibatterier att öka deras livslängd.
Jordbruksavel
Inom jordbruket kan frön som majs, rödbetor, ärtor, vete och solrosor behandlas med scandiumsulfat (koncentrationen är vanligtvis 10⁻³ ~ 10⁻⁶ mol/L, olika växter har olika resultat), och den faktiska effekten av att främja groning har uppnåtts. Efter 8 timmar ökade torrvikten för rötter och knoppar med 37 % respektive 78 % jämfört med plantor, men mekanismen är fortfarande under utredning.
Från Nielsens uppmärksamhet på atommassadata fram till idag har scandium bara funnits i människors ögon i hundra eller tjugo år, men det har nästan legat på bänken i hundra år. Det var inte förrän den kraftiga utvecklingen av materialvetenskapen i slutet av förra seklet som det gav honom vitalitet. Idag har sällsynta jordartsmetaller, inklusive scandium, blivit heta stjärnor inom materialvetenskapen, spelar ständigt föränderliga roller i tusentals system, ger mer bekvämlighet i våra liv varje dag och skapar ekonomiskt värde som är ännu svårare att mäta.
Publiceringstid: 29 juni 2023